某企业是一家以生产电缆类产品为主的地方明星企业。在电缆生产过程中,不可避免地会产生一定量的含铜废料(如:零碎电缆)。某化学兴趣小组的同学得知这一情况后,提出可以用含铜废料制备胆矾(CuSO4·5H2O)。 I、硫酸铜的制备 方案1:甲同学根据已学知识,提出了制备硫酸铜方案:  方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:
方案2:乙同学根据查阅资料找到了一种工业制备硫酸铜的流程:  (1)上述方案中的①、②、③三处,与铜或铜的化合物有关的化学反应方程式分别是: ①___\_; ②____\_; ③___________; (2)从环保角度对两套方案的不同部分进行比较,你认为方案_____\_(填1或2)更合理。理由是:__________。 (3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的原因为______ (4)若上述方案所用的稀硫酸溶质质量分数为36.8%,问每1L98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸____\_g,需水________\_ L(水的密度为1.0g/mL)。在实验室中稀释浓硫酸时,是如何操作的:___________。 (5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体。晶体采用酒精淋洗的优点是 _______。 II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定 在老师的指导下,学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行热分解,获得相关数据,并绘制成固体质量一温度的关系如图。
(1)上述方案中的①、②、③三处,与铜或铜的化合物有关的化学反应方程式分别是: ①___\_; ②____\_; ③___________; (2)从环保角度对两套方案的不同部分进行比较,你认为方案_____\_(填1或2)更合理。理由是:__________。 (3)方案2中,加入H2O2后要求温度控制在50℃到60℃加热的原因为______ (4)若上述方案所用的稀硫酸溶质质量分数为36.8%,问每1L98%的浓硫酸(密度为1.84g/mL)能配制出这种稀硫酸____\_g,需水________\_ L(水的密度为1.0g/mL)。在实验室中稀释浓硫酸时,是如何操作的:___________。 (5)兴趣小组同学一致指出,将滤液经蒸发、降温结晶等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体。晶体采用酒精淋洗的优点是 _______。 II、硫酸铜晶体(CuSO4·xH2O)中结晶水(xH2O)含量的测定 在老师的指导下,学习小组取12.5g硫酸铜晶体(CuSO4·xH2O)进行热分解,获得相关数据,并绘制成固体质量一温度的关系如图。
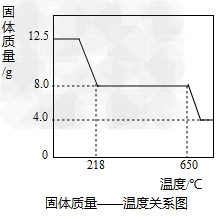
(1)在加热过程中,随着水分的失去,固体颜色将由蓝色逐渐变为________色,最终变为黑色; (2)650℃以上时,硫酸铜固体就会发生分解,生成黑色金属氧化物、二氧化硫及氧气,此反应的化学方程式为________ ; (3)根据图中数据,计算CuSO4·xH2O中x的值为_________。(请写出计算过程) (4)若将4.0g剩余固体继续加热到更高的温度,发现固体质量减少了0.4g后质量不再改变,写出此过程中可能发生反应的化学方程式:_________。 Ⅲ、硫酸铜的应用波尔多液是用硫酸铜和石灰乳配成的一种天蓝色、粘稠的悬浊液,其有效成分是Cu4(OH)6SO4,其中铜元素的化合价为______。碱式盐可以写成盐和碱的形式,例如碱式碳酸铜可以写成CuCO3·Cu(OH)2,则Cu4(OH)6SO4可以写成盐和碱的形式为______,其杀菌机理可看作是Cu2+使病原菌失去活性,这说明病原菌的主体是________(填一种有机物名称)。
凯氏定氮法测定食品中的蛋白质使用的催化剂是
A、硫酸铜和氯化钾
B、硫酸铜和氢氧化钠
C、硫酸铜和硫酸钾
D、硫酸铜和硼酸
E、硫酸铜和硫酸铵